دنیای علم برای همه
با سلام. این وبلاگ زیر نظر وبلاگ اختصاصی کلاس نهم 02 علامه جعفری مرند(http://hashtom02.blogsky.com/) طراحی شده است.امیدوارم لذت ببرید و گوشه ای از علم را برای شما روشن سازیم.دنیای علم برای همه
با سلام. این وبلاگ زیر نظر وبلاگ اختصاصی کلاس نهم 02 علامه جعفری مرند(http://hashtom02.blogsky.com/) طراحی شده است.امیدوارم لذت ببرید و گوشه ای از علم را برای شما روشن سازیم.انواع پیوند شیمیایی و ویژگی های آن
به ادامه مطلب مراجعه فرمایید.
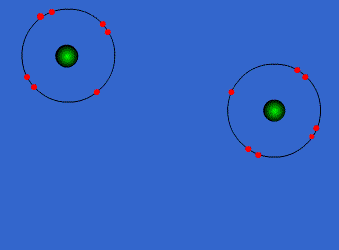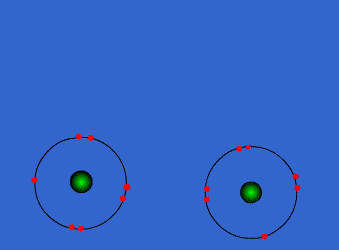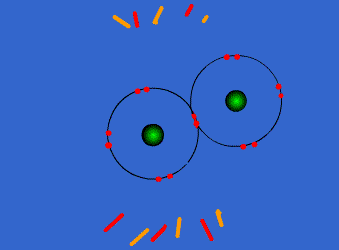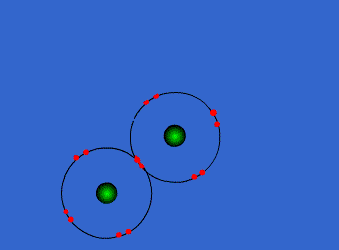
اتمها به جای آنکه به صورت منفرد بمانند، تمایل دارند به یدیگر بپیوندند، به هم پیوستن اتمها با تشکیل پیوندهای شیمیایی صورت میگیرد. پیوندهای شیمیایی نبروهای جاذبهای هستند که در تمام مواد، اتمها را به یکدیگر متصل میکنند. تشکیل پیوند بین اتمها با تغییر آرایش الکترونی آنها همراه است. در حقیقت، این الکترونهای لایهی ظرفیت اتمها هستند که سبب تشکیل پیوندهای شیمیایی میشوند.
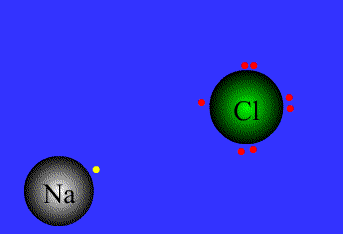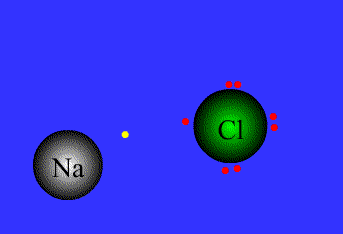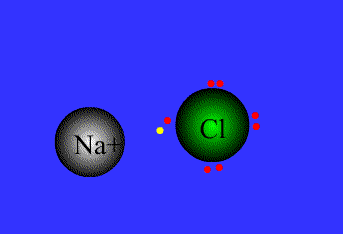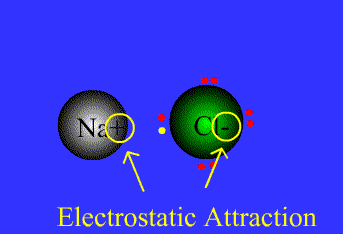
در ادامه به بیان انواع پیوندها و خواص آن ها می پردازیم1- پیوند یونی: نیروی جاذبه قویی است که بین یونهای با بار مخالف وجود دارد. این پیوند نتیجهی انتقال الکترون از اتم فلز به اتم نافلز است. پیوند یونی را پیوند الکترووالانسی نیز مینامند. ترکیبات یونی متشکل از تعداد زیادی آنیون وکاتیون هستند که با طرح معین هندسی در کنار هم قرار گرفتهاند و یک بلور بوجود میآورند. هر بلور ، به سبب جاذبههای منفی ـ مثبت یونها به هم ، نگه داشته شده است. فرمول شیمیایی یک ترکیب یونی نشانه ساده ترین نسبت یونهای مختلف برای به وجود آوردن بلوری است که از نظر الکتریکی خنثی باشد.
خواص ترکیب های یونی
الف- رسانایی الکتریکی :
رسانایی الکتریکی مواد مرکب یونی مذاب به این علت است که وقتی قطبهایی با بار مخالف در این مواد مذاب قرار گیرد و میدان الکتریکی برقرارشود، یون ها آزادانه به حرکت در میآیند. این حرکت یونها بار یا جریان را از یکجا به جای دیگر منتقل میکنند. در جسم جامد که یونها بیحرکتاند و نمیتوانند آزادانه حرکت کنند، جسم خاصیت رسانای الکتریکی ندارد.
ب- سختی :
سختی مواد مرکب یونی به علت پیوند محکم میان یونهای با بار مخالف است. برای پیوندهای قوی انرژی بسیاری لازم است تا یونها از هم جدا شوند و امکان حرکت آزاد حالت مذاب را پیداکنند. انرژی زیاد به معنی نقطه جوش بالا است که خود از ویژگیهای مواد مرکب یونی است.
ج- شکنندگی :
مواد مرکب یونی شکنندهاند. زیرا که ساختار جامد آنها آرایه منظمی از یونهاست. مثلا ساختار سدیم کلرید (NaCl) را در نظر بگیرید. هرگاه یک سطح از یونها فقط به فاصله یک یون در هر جهت جابجا شود، یونهایی که بار مشابه دارند درکنار یکدیگر قرار میگیرند و یکدیگر را دفع میکنند و چون جاذبهای در کار نیست بلور میشکند. سدیم کلرید را نمیتوان با چکش کاری ، به ورقههای نازک تبدیل کرد. با چنین عملی بلور نمک خرد و از هم پاشیده میشود.
گروههای حاوی پیوند یونی
پس از جدا شدن یک الکترون از یک اتم معین ، جداشدن الکترونهای بعدی به ترتیب مشکل تر میشود. زیرا با از دست رفتن هر الکترون بار مؤثر زیادتری میشود و الکترونهای باقیمانده را محکمتر نگاه میدارد. بطور خلاصه یونهای مثبت وقتی تشکیل میشوند که اتمهای فلزی یک الکترون گروه(IA ) ، دو الکترون گروهIIA) ) و یا سه الکترون گروه (IIIA) به اتمهای غیر فلزی میدهند. یونهای حاصل آرایش الکترونی یکسان با یک گاز نجیب دارند.
a- عناصرگروه( IA ) فلزات قلیایی Li : ، Na ، K ، Rb ، Cs ، هر یک به ترتیب یک الکترون بیشتر از گازهای نجیب (He ، Kr ، Ne ، Ar ، Xe ) دارند. اگر هر یک از این فلزات از هر اتم یک الکترون از دست بدهند، جزء باقیمانده آرایش الکترونی گاز نجیب متناظر خود را پیدا میکند. مثلا ، Li یک الکترون والانس در آرایش حالت پایه دارد. از دست دادن یک الکترون موجب میشود که Li ساختار الکترونی He را پیداکند. یک اتم Li که فقط دو الکترون و سه الکترون داشته باشد، بار+ 1 خواهد داشت.
b- عناصر گرو(IIA) فلزات قلیایی خاکی : هریک دو الکترون والانس دارند. پس برای اینکه Mg ، Ca ، Sr ، Ba ساختار گاز نجیب را به دست آورند اتمهای هرعنصر باید دو الکترون از دست بدهند. از دست رفتن دو الکترون موجب میشود که دو پروتون در هسته خنثی نشده بماند. پس هر یون بار + 2خواهد داشت. برای جدا شدن سومین الکترون لازم است جفت الکترونهای تراز اصلی با انرژی پایینتر شکسته شود. این امر انرژی زیادتری میخواهد.
C- عناصر گروه( VIIA) هالوژنها
یونهای مثبت در حضور یونهای منفی پایدار میشوند. خنثی شدن بار ، هر دو نوع یون را پایدار میکند. یونهای منفی پایدار ، از اتمهایی که شش یا هفت الکترون والانس دارند، تولید میشوند. این گونه اتمها آنقدر الکترون بدست میآورند تا ساختار گاز نجیب را پیدا کنند. مثلا اتمهای عناصر گروه VIIA (هالوژنها) هفت الکترون والانس دارند و هر یک ، یک الکترون میخواهند تا آرایش الکترونی یک گاز نجیب را پیدا کنند.
اگر اتمهای F ، Cl ، Br ، I هر یک ، یک الکترون بدست آورند، یونهای حاصل یعنی F-، Cl-، Br وI- به ترتیب آرایش الکترونی گازهای نجیب (Ne ، Ar ، Kr ، Xe ) را خواهند داشت.
d- عناصر گروه (VIA) گروه اکسیژن
اتم عناصر (VIA) برای رسیدن به ساختار الکترونی یک گاز نجیب هریک دو الکترون نیاز دارند. اضافه شدن دو الکترون به هر اتم ، سبب تولید آنیون (یون دو بارمنفی) میشود.
بطور خلاصه غیرفلزات یک ، دو ، یا سه الکترون از فلزات میگیرند و یون منفی ایجاد میکنند.این یون های منفی همگی الکترون های والانس جفت شده و آرایش هشت الکترونی پایدار گازهای نجیب را دارند.- پیوند کووالانسی:
میلیونها ماده مرکب شناخته شده است که فقط از غیر فلزات ترکیب یافتهاند. این مواد مرکب فقط شامل عناصری هستند که در هر اتم 4، 5 ،6 یا 7 الکترون والانس دارند. بنابراین الکترونهای والانس اتمهای غیر فلزی ، آنقدر زیاد است که اتمها نمیتوانند با از دست دادن آنها ساختار یک گاز نجیب را به دست آورند. معمولا غیر فلزات با جفت کردن الکترونها پیوند ایجاد میکنند و در این فرآیند به ساختار یک گاز نجیب میرسند.
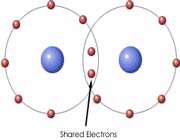
یکی دیگر از راه هایی که یک اتم میتواند به آرایش الکترونی پایدار برسد، این است که با یک یا چند اتم دیگر الکترون به اشتراک بگذارد. هنگامی که دو اتم الکترون به اشتراک میگذارند، نیروی جاذبهای بین آنها بوجود میآید که سبب به هم پیوستن آن دو اتم به یکدیگر میشود و این نیروی جاذبه به پیوند کووالانسی نام دارد. آنچه اتمهای یک ملکول را به هم نگه میدارد، پیوند کووالانسی است، در تشکیل پیوند کووالانسی الکترونها ، به جای آنکه از اتمی به اتم دیگر منتقل شوند، میان دو اتم به اشتراک گذاشته میشوند. استحکام پیوند کووالانسی ناشی از جاذبه متقابل دو هسته مثبت و ابر منفی الکترونهای پیوندی است. یا به عبارت دیگر مربوط به آن است که هر دو هسته الکترونهای مشترکی را جذب میکنند.
شرط تشکیل پیوند کوولانسی: لازمه تشکیل پیوند کوولانسی بین دو اتم ، این است که هر یک از دو اتم در آخرین تراز انرژی خود لااقل یک اوربیتال نیمه پر داشته باشند.
انواع پیوند کووالانسی
الف- پیوند یگانه کووالانسی
پیوند یگانه کووالانسی متشکل از یک جفت الکترون (دارای اسپین مخالف) است که اوربیتالی از هر دو اتم پیوند شده را اشغال میکند. سادهترین نمونه اشتراک در مولکولهای دو اتمی گازهایی از قبیل F2 ، H2 و Cl2 دیده میشود. اتم هیدروژن فقط یک الکترون دارد هرگاه دو اتم هیدروژن تک الکترونهای خود را به اشتراک بگذارند، یک جفت الکترون حاصل میشود. H ― H , H : H پیوند یگانه
این جفت الکترون پیوندی متعلق به کل مولکول هیدروژن است و به آرایش الکترونی پایدار گاز نجیب هلیم میرسد. هراتم هالوژن ، هفت الکترون والانس دارد. با تشکیل یک پیوند کووالانسی بین دو تا از این اتمها ، هر اتم به آرایش الکترونی هشت تایی ، که ویژه گازهای نجیب است، میرسد.
ب- پیوند چند گانه
بین دو اتم ، ممکن است بیش از یک پیوند کووالانسی تشکیل شود در این موارد گفته میشود که اتمها با پیوند چند گانه به هم متصلاند. دو جفت الکترون مشترک را پیوند دو گانه و سه جفت الکترون مشترک را پیوند سه گانه مینامند. اغلب میتوان تعداد پیوندهای جفت الکترونی را که یک اتم در یک مولکول بوجود میآورد از تعداد الکترونهای مورد نیاز برای پر شدن پوسته والانس آن اتم ، پیشبینی کرد.
چون برای نا فلزات شماره گروه در جدول با تعداد الکترونهای والانس برابر است، میتوان پیش بینی کرد که عناصر گروه VIIA مثل) Cl با هفت الکترون والانس) ، برای رسیدن به هشت تای پایدار ، یک پیوند کووالانسی ، عناصر گروه VIA مثل O و) S با شش الکترون والانس) دو پیوند کووالانسی ، عناصر VA مثل N و) P با پنج الکترون والانس) سه پیوند کووالانسی و عناصر گروه IVA مثل C (با چهار الکترون والانس) چهار پیوند کووالانسی به وجود خواهند آورد. :Ö=C=Ö: پیوند دو گانه ، پیوند سه گانه ، چهار پیوند کربن که یک پیوند سه گانه و یک پیوند یگانه تشکیل داده ااست.- پیوند داتیو (کووالانسی کوئوردینانس):
کلمهی داتیو به زبان یونانی یعنی بخشنده این پیوند زمانی تشکیل میشود که یک اتم دارای زوج الکترون تنها و اتم دیگر اوربیتال خالی داشته باشد.
پیوند داتیو
شرط تشکیل پیوند داتیو:در تشکیل پیوند داتیو باید اتمی که الکترون به اشتراک میگذارد، در آخرین لایه ، حداقل یک جفت الکترون غیر پیوندی داشته باشد و اتم دیگر نیز حداقل دارای یک اوربیتال خالی در آخرین لایه باشد ).اوربیتال: فضایی است که احتمال حضور بیشترین الکترون را داشته باشد .)
اتم نیتروژن با سه اتم هیدروژن ، پیوند کووالانسی معمولی تشکیل میدهد و به آرایش الکترونی گاز بیاثر میرسد. پس از این عمل ، برای نیتروژن یک جفت الکترون غیر پیوندی باقی میماند که میتواند آن را بصورت داتیو در اختیار اتمهایی که به آن نیاز دارند، قرار دهد. از سوی دیگر ، اتم هیدروژن که یک الکترون در اوربیتال آن موجود است، هر گاه این الکترون را از دست بدهد، به یون H+تبدیل میشود که اوربیتال 1S آن خالی است.حال هرگاه این یون به مولکول آمونیاک نزدیک شود، با آن پیوند داتیو برقرار میکند و خود را به آرایش الکترونی گاز بیاثر میرساند (NH4+) این مجموعه که یون آمونیوم نامیده میشود، در بسیاری از ترکیبات مانند کلرید آمونیومNH4Cl) ) و هیدروکسید آمونیوم(NH4OH) وجود دارد.
اندازه گیریهای انجام شده نشان میدهد که انرژی و طول هر چهار پیوند نیتروژن _ هیدروژن در یون آمونیوم کاملا یکسان است. این امر منطقی نیز به نظر میرسد، زیرا پیوند داتیو نیز مانند پیوند کووالانسی معمولی یک جفت الکترون است که بین هسته اتم نیتروژن و هسته اتم هیدروژن قرار گرفته استکلرید آلومینیوم نیز با یون Cl- ترکیب میشود و یون AlCl 4- تولید میکند که در آن هر چهار پیوند AL - Cl از نظر طول و انرژی یکسان هستند.4- پیوندهای فلزی
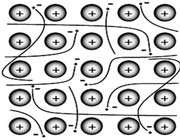
پیوند فلزی: نیروی جاذبهای که از تأثیر متقابل الکترونهای غیر مستقر (یعنی همان الکترونهای لایهی ظرفیت) و ذرههای مثبت شبکهی بلور فلز به وجود میآید عامل پیدایش پیوند فلزی میباشد
فلزات به وسیلة رسانایی الکتریکی بالا، جلای فلزی و چکشخواری مشخص میشوند. کدام آرایش پیوندی میتواند پدید آورندة این خواص باشد؟ فلزات در حالت جامد بلورهایی تشکیل میدهند که در آنها هر اتم با هشت یا دوازده اتم فلز احاطه شده است.
نظر به این که فلزات در تراز بیرونی خود فقط 1،2 یا 3 الکترون دارند، اتم های آنها با اتم های مجاور خود پیوندهای کووالانسی عادی تشکیل نمیدهند و چون اتمهای یک عنصر نیروی جاذبة یکسانی نسبت به الکترونهای خود دارند، اتم های فلز تمایلی به تشکیل یون در بلور فلز ندارند. در اینجا، بلور فلز وقتی تشکیل میشود که اتمها در کنار یکدیگر جمع میشوند و اوربیتال های تراز بیرونی تمام اتم ها با یکدیگر همپوشانی میکنند. در این حالت الکترون ها میتوانند به راحتی از یک اتم به اتم دیگر حرکت کنند. در اینجا گفته میشود که الکترون ها غیرمستقرند زیرا این الکترونها در یک «مکان» به عنوان بخشی از یک یون یا پیوند کووالانسی معین قرار نگرفتهاند. اگر یک میدان الکتریکی خارجی اعمال کنیم، الکترونها در درون فلز به جریان میافتند و جریان الکتریکی به وجود میآید. الکترونها غیرمستقر به آسانی با نور بر هم کنش داشته، جلای فلزی را به وجود میآورند. وقتی فلزات را با چکش میکوبیم، اتمها تغییر آرایش میدهند و الکترونها نیز در اوربیتالهای اتمها در مکانهای جدید جابجا میشوند. الکترونهای غیرمستقر که اتمهای فلزی را به یکدیگر متصل نگه میدارند پیوند فلزی را به وجود میآورند.
خواص فلزات با تعداد الکترونهای بیرونی آنها معین میشود. فلزات گروه (IA)1 در هر اتم فقط یک الکترون بیرونی دارند. این فلزات نرم هستند. فلزات گروه(IIA)2 دو الکترون بیرونی دارند و در مقایسه با فلزات گروه (IA)1 سختترند. اما، در فلزات واسطه، الکترون های اوربیتالهای d ممکن است در تشکیل پیوند فلزی شرکت کنند. بسیاری از این فلزات بسیار سخت هستند.
عناصر گروه (IIIB) 3 تا (VIB)6 سه تا شش الکترون غیرمستقر دارند. در عناصر گروه های (VIIB)7 تا (VIIIB)10، تعداد الکترون های غیرمستقر همان شش الکترون است زیرا الکترون های تراز فرعی d این عناصر در پیوند فلزی شرکت ندارند. تعداد الکترون های غیرمستقر به ازای هر اتم با فلزات گروههای (IB)11 و (IIB)12 رو به نقصان میگذارد. گروه های (IIIA)13 تا (VIIIA)18، نافلزند و از خواص فلزی آنها به سرعت کاسته میشود.
پیوند فلزی قوی در فلزات ساختمانی مانند آهن، کروم و نیکل، این فلزات را سخت و محکم ساخته است. به طورکلی، عناصر واسطه، سختترین و محکمترین عناصر هستند. بعضی از فلزات که الکترون های غیرمستقر کمتری دارند را میتوان با سایر فلزات ترکیب کرد و آلیاژ تشکیل داد و به این ترتیب باعث استحکام فلز شد. خواص این آلیاژها از خواص عناصر خالص سازندة آلیاژ متفاوت است.پیوندهای بین مولکولی
اتمها در مولکولها توسط پیوندهای کووالانسی کنار هم نگه داشته شدهاند. اما سوال این است که مولکولها در حال مایع و جامد توسط چه نیرویی بسوی یکدیگر جذب میشوند، نیروهایی که مولکولهای یک ماده را در حالت مایع یا جامد به همدیگر ارتباط میدهد به نیروهای بین مولکولی معروف است. دو نوع نیروی جاذبه ی مولکولی وجود دارد:
1- نیروهای واندروالسی 2- پیوند هیدروژنی
اولین بار 'یوهانس واندروالس' در سال 1873 وجود نیروهای جاذبه بین مولکولی در میان مولکولهای گاز را مطرح کرد توضیح منشأ این نیروهای بین مولکولی توسط 'فرتینر لاندن' در 1930 پیشنهاد شد. امروزه نیروهای بین مولکولی را بصورت عام نیروهای واندروالس و نیروهای پراکندگی بین مولکولهای غیرقطبی را نیروهای لاندن مینامند. (نیروهای ضعیف بین موکلولها را مجموعاً تحت عنوان نیروهای واندروالس مینامند.)
نیروهای بین مولکولی مولکولهای قطبی با نیروهای بین مولکولی بین مولکولهای غیرقطبی باهم تفاوت دارند. معمولا نیروهای بین مولکولی به نام نیروهای واندروالسی معروفند. وجود این نیروها در بین مولکولها باعث میشود که یک ترکیب جامد مولکولی شکل معینی داشته باشد و با غلبه بر این نیروها بتوان آن را به حالت مایع درآورد.انواع نیروهای واندروالسی
1- نیروهای دوقطبی - دوقطبی
این نیروها بین مولکول های قطبی دیده میشوند. این مولکولها دارای دوقطبی های دائمی هستند و تمایل به قرار گرفتن در راستای میدان الکتریکی دارند. پایدارترین حالت زمانی است که قطب مثبت یک مولکول تا حد امکان به قطب منفی مولکول مجاور نزدیک باشد. در این شرایط بین مولکولهای مجاور یک نیروی جاذبه الکتروستاتیکی به نام نیروی دوقطبی بوجود میآید.
با توجه به مقادیر الکترونگاتیوی اتمها در یک مولکول دو اتمی میتوان میزان قطبیت مولکول و جهتگیری قطبهای مثبت و منفی را پیش بینی کرد، اما پیش بینی قطبیت مولکولهای چند اتمی باید مبتنی بر شناخت شکل هندسی مولکول و آرایش جفت الکترونهای غیر مشترک باشد.
نیروی لاندن(نیروی پراکندگی)
برای اینکه ترکیبی به صورت جامد یا مایع باشد. باید نیروهایی ، مولکولهای آن ترکیب را کنار هم نگه دارد. در ترکیبات قطبی به علت وجود اختلاف الکترونگاتیوی بین دو اتم ، دو بار جزئی مثبت و منفی در دو سر مولکول حاصل میشود و این نیروی دوقطبی ، مولکولها را کنار هم نگه میدارد. برای توجیه حالت مایع و جامد مواد غیرقطبی مانند برم و ید نیز ، نیروی جاذبه دیگری باید وجود داشته باشد.
چون نقاط ذوب و جوش مواد غیرقطبی با افزایش جرم مولکولی بالا میرود، نتیجه میگیریم که مقدار این نیرو نیز با جرم و اندازه مولکول زیاد میشود. این واقعیت که فراریت مولکولهای قطبی مانند مولکولهای غیرقطبی با افزایش وزن مولکولی کم میشود، نشان میدهد که این نوع نیروی بین مولکولی باید برای همه مواد مولکولی متداول باشد.
اهمیت نیروی لاندن
از میان نیروهای بین مولکولی ، نیروی لاندن از همه مهمتر میباشد. این نیرو تنها نیروی جاذبه میان مولکولهای غیر قطبی است. حتی تخمین زده شده است که 85 درصد از کل نیروهای میان مولکولی در مولکول قطبی HCl ناشی از نیروی لاندن میباشد. فقط در مولکولهایی که پیوند هیدروژنی دارند، این نیروها نقش فرعی را ایفا میکنند.
برای مثال حدود 80 درصد از نیروهای جاذبه بین مولکولی در آب ، متعلق به پیوند هیدروژنی است و فقط 20 درصد بقیه مربوط به نیروهای پراکندگی (لاندن( میباشد. قویترین نیروهای لاندن بین مولکولهای کمپلکس و بزرگ دیده میشوند که ابر الکترونی بزرگی دارند که به آسانی تغییر شکل داده و قطبی میشوند، این ترکیبات نقاط ذوب و جوش نسبتا بالایی دارند.
ماهیت نیروهای لاندن
منشا و دلیل بوجود آمدن این نیروی بین مولکولی در سال 1930، توسط 'فرتیز لاندن' توضیح داده شد. این نیرو همانند سایر نیروهای بین مولکولی (دوقطبی - دوقطبی و پیوند هیدروژنی ( ماهیت الکتریکی دارد. اما برخلاف آنها که از قطبیت دائم مولکولها بوجود میآیند، نیروی لاندن (یا پراکندگی) از جدایی بار موقتی و لحظهای در درون یک مولکول حاصل میشود.
مولکولهای غیرقطبی ، دوقطبی دائمی ندارند ولی با وجود این ، تمام مواد غیرقطبی را میتوان مایع کرد. از اینرو ، علاوه بر نیروی دوقطبی - دوقطبی ، باید نوع دیگری از نیروی بین مولکولی وجود داشته باشد. وجود نیروهای پراکندگی در مولکولها بعنوان یک اصل پذیرفته شدهاست. تصور میشود این نیروها ناشی از حرکت الکترونها باشد. در یک لحظه از زمان ، ابر الکترونی یک مولکول بنحوی تغییر شکل میدهد که یک دوقطبی لحظهای بوجود میآید که در آن ، قسمتی از مولکول به مقدار بسیار کم منفیتر از قسمت های دیگر است و در لحظه بعد ، بعلت حرکت الکترون ها جهت دوقطبی لحظهای تغییر میکند.
اثر این دوقطبی های لحظهای در طول زمان بسیار کوتاه ، یکدیگر را حذف میکنند، بصورتی که مولکول غیر قطبی فاقد دوقطبی دائمی میشود. ولی دوقطبی های مواج لحظهای یک مولکول ، دوقطبی های نظیر خود را در مولکولهای مجاور القا میکنند و حرکت همزمان الکترون های مولکولهای مجاور باعث ایجاد نیروی جاذبه بین این دو قطبی های لحظهای ، نیروی لاندن را تشکیل میدهند. نیروی لاندن بین مولکول های قطبی هم وجود دارد، اما تنها نیروی بین مولکولی موجود در مولکول های غیرقطبی است.
منشأ ایجاد این نیروها ، حرکت الکترون ها میباشد. الکترونها در مولکول های غیرقطبی مانند H2 بطور متوسط به هر اندازه که به یک هسته نزدیک باشند، به همان اندازه به هسته دیگر نزدیکند. اما در یک لحظه ابر الکترونی میتواند در یک انتهای مولکول متمرکز شود و در لحظه بعد این ابر الکترونی در انتهای دیگر مولکول باشد.
چگالی لحظهای الکترون ها در یک طرف مولکول و قسمت دیگر آن یک دوقطبی موقت در مولکول H2 بوجود میآورد. این موضوع به نوبه خود یک دوقطبی مشابه در مولکول مجاور القا میکند. این دوقطبیهای موقت که هر دو در یک مسیر جهتیابی شدهاند، نیروی جاذبهای میان مولکول ها ایجاد میکنند که به نیروی پراکندگی یا لاندن معروف است.
عوامل موثر در ایجاد نیروهای لاندن
قدرت نیروهای لاندن به این بستگی دارد که وقتی یک دوقطبی موقت در مجاورت یک مولکول برقرار میشود، با چه سهولتی میتواند توزیع الکترونی آن مولکول را قطبیده کند. سهولت قطبی شدن در درجه اول به اندازه مولکول بستگی دارد. دوقطبی شدن مولکول های بزرگ که الکترون ها دورتر از هسته میباشند، آسان تر از مولکولهای کوچک که الکترون ها به هسته نزدیک هستند صورت میگیرد. با افزایش اندازه مولکول و وزن مولکول بر قدرت نیروهای لاندن افزوده میشود.
البته نیروهای لاندن بیشتر به اندازه و شکل مولکول بستگی دارند تا به جرم آن. از میان دو مولکولی که دارای وزن مولکولی یکسان ولی شکل و اندازه مختلفی هستند، الکترون های مولکول کوچکتر و فشرده تر آزادی کمتری دارند و دوقطبی لحظهای براحتی در مولکول ایجاد نمیشود. بنابراین نیروی بین مولکولی آنها ضعیفتر از نیروی بین مولکولی مولکول بزرگتر میباشد که الکترونهایش آزادی عمل بیشتری دارند.
بنابراین نیروهای لاندن در مولکولهای فشرده و متقارن ، ضعیف تر از مولکول های با اتم های سبک ، طویل و استوانهای شکل (سطح زیاد مولکول) میباشد و به همان علت نقاط ذوب و جوش این ترکیبات فشرده کمتر از مولکولهای بزرگ میباشد، هرچند که جرم مولکولی یکسانی داشته باشند.
نیروی واندروالسی به چه عواملی بستگی دارد؟
1- هر چه جرم مولکولی بیشتر باشد نیروی واندروالس بین مولکولها بیشتر است. و هر چه نیروی واندوالسی بیشتر باشد یعنی مولکولها سفت تر هم را چسبیده اند پس نقطه ی جوش و ذوب بالاتر است.
2- هر چه تعداد اتمها در ساختار یک مولکول بیشتر باشد نیروی واندروالس بین دو مولکول بیشتر است و بنابر این نقطه ی ذوب و جوش بالاتر است. مثلا S8 نیروی واندروالس بیش از P4 دارد.